Magyarország veszélyhelyzeti törvénykezését bírálják nemzetközi gyógyszergyártó szervezetek, és emiatt az amerikai elnök hivatalához fordultak - írja a HVG. Az amerikai gyógyszerkutatók és -gyártók szövetsége (PhRMA), a Biotechnológiai Innovációs Szervezet (BIO) és más tömörülések Joe Bidennek írt levelükben elsősorban azoknak a feltörekvő országoknak a gyakorlatát kifogásolták, amelyek a szellemi tulajdon védelmét figyelmen kívül hagyva vágtak bele a Covid-19 elleni vakcina gyártásába.
Miközben a vállalatok hangsúlyozták, hogy maguk is részt vesznek az oltóanyagok igazságosabb elosztására hivatott, Covax nevű globális programban, kifogásolták, hogy India és Dél-Afrika a szellemi tulajdonjogra vonatkozó nemzetközi egyezmények felfüggesztését szorgalmazta, hogy fel lehessen pörgetni a vakcinák előállítását. A szegényebb országok amiatt aggódnak ugyanis, hogy az Economist Intelligence Unit kalkulációi szerint a gyártókapacitások lassú felfutása miatt Afrikában csak jövőre tudják megkezdeni az oltásokat és csak 2024-re akakulhat ki védettség.
Kapcsolódó
A HVG szerint az amerikai elnöknek írt levélben név szerint ugyan nem szerepel Magyarország, ám ugyanezek a gyógyszergyártók az Egyesült Államok kereskedelmi képviseletét ellátó hivatalnak azt jelezték: a veszélyhelyzeti törvénnyel a magyar parlament lehetővé tette a gyógyszerészeti szabadalmak védelméről szóló nemzetközi egyezmény megkerülését.
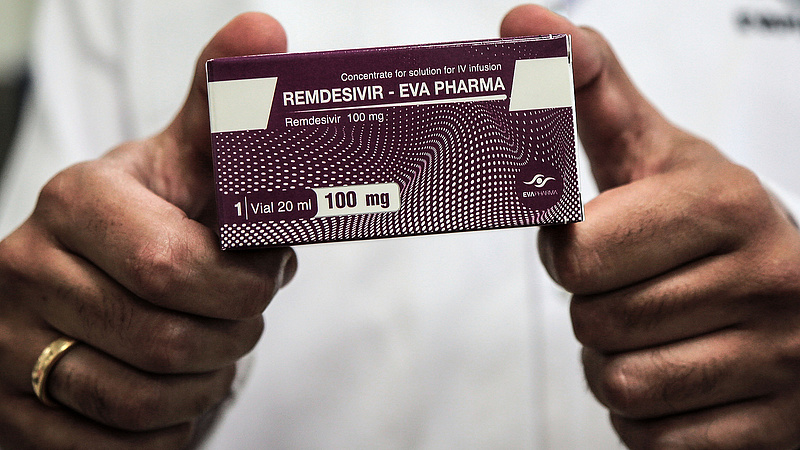
A beadványában a BIO példaként éppen a magyar kormány intézkedését hozta fel, amellyel lehetővé vált a remdesivir alkalmazása és magyarországi gyártása a covidos betegek kezelésére, és mindez - állításuk szerint - anélkül történt, hogy a kormány kapcsolatba lépett volna a szabadalom birtokosával. Ráadásul Magyarország az Európai Unión keresztül is hozzájuthatott volna a gyógyszerhez.
A HVG cikke megjegyzi, hogy a Richter októberben közölte, hogy a kormány fekérésére állami finanszírozással 5 hónap alatt megoldotta a hatóanyag szintézisét, és legyártott háromezer betegnek való remdesivirt. Az innovációs miniszter szerint ez 400 millió forintba került.
A Richter a HVG-nek azt mondta, hogy minden jogszabályt betartottak, és az infúziós gyógyszer generikus fejlesztése jelenleg is folyik az arra vonatkozó belső előírások szerint. A készítményt kutatás-fejlesztési tevékenység keretében állították elő, ennek célja a klinikai vizsgálatok elvégzése volt, amihez a Richter szerint nem kell előzetes egyeztetés a gyártóval. A Richter részéről ugyanakkor azt is megjegyezték, hogy a külföldiek által kifogásolt veszélyhelyzeti mechanizmus nem a gyártó kompetenciája, arról a kormány döntött.
Legolvasottabb

Ha önnél is lapul régi telefon, most megszabadulhat tőle

Gigantikus gödör tárul elénk Pakson, jött egy dátum az új erőműről

Orbán Viktor régi barátainak köszönhető, hogy Ukrajna fegyverekhez jut

Visszaélés a napenergiával – a GVH-hoz fordult az Integritási Hatóság

Belenyúlt az ügyfelek eredményeibe az Erste, hogy neki kedvezőbb csomagot sózhasson rájuk